Воспроизведённые в России лекарства будет легче зарегистрировать
Тема: Пленарное заседание Совета Федерации 16 декабря 2020 года
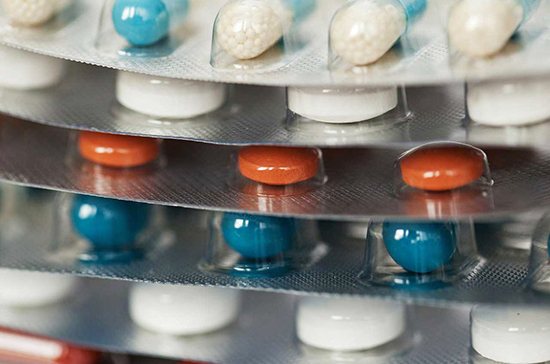
Порядок проверки вспомогательных веществ в составе лекарств предложено уточнить, что будет способствовать упрощению регистрации воспроизведённых в России лекарств. Соответствующий закон одобрен Советом Федерации 16 декабря.
Закон направлен на гармонизацию национального законодательства РФ с правом Евразийского экономического союза, пояснил член Комитета Совета Федерации по социальной политике Юрий Архаров.
«Процедура регистрации лекарственного препарата для медицинского применения приводится в соответствие с актами, составляющими право ЕАЭС», — отметил он.
Согласно инициативе, Минздрав освобождается от полномочий по утверждению порядка проверки вспомогательных веществ в составе воспроизведённых лекарств, призванной доказать, что данные вещества не влияют на безопасность и эффективность препаратов. Согласно проекту закона, такие исследования должны проводиться в соответствии с актами, составляющими право ЕАЭС.
Также федеральным законом в целях исключения правового пробела вносятся дополнения в законодательство, позволяющие производителю фармацевтической субстанции осуществлять реализацию фармсубстанции этилового спирта производителям медицинских изделий, отметил сенатор. Как ранее уточнял член Комитета Госдумы по охране здоровья Александр Петров, данный законопроект относится к блоку инициатив, призванных упростить процедуру регистрации воспроизведённых лекарств в России.
Также читайте о том, какие законы вступают в силу в декабре.



 1286
1286






